ウイルスや細菌、寄生虫(原虫)などの細胞内寄生性病原体の感染に対して、我々宿主には免疫系が備わっています。病原体が感染してまず対応するのは自然免疫系です。自然免疫系はリポ多糖やペプチドグリカンや非メチル化DNAや一本鎖RNAといった宿主にはない病原体特有のパターン(Pathogen Associated Molecular Pattern = PAMP)を「自己」と「非自己」の境界線にしています。次に自然免疫系の次にB細胞やT細胞が担う獲得免疫系が活性化します。通常、獲得免疫系は病原体にしかないタンパク質由来の抗原を認識する抗体や抗原受容体を持つT細胞の活性化を起こします。自然免疫系や獲得免疫系だけでは、細胞内に感染した病原体を細胞内に感染した病原体の増殖を止め、そして殺傷することはできません。この細胞内寄生性病原体の殺傷を担う免疫系が、自然免疫系や獲得免疫系によって産生されるインターフェロンによって活性化する細胞自律的免疫系(セルオートノマス免疫系)です。免疫系の根幹には「自己」と「非自己」の厳密な認識があります。自然免疫系や獲得免疫系が識別するPAMPや非自己由来のタンパク質と比較して、セルオートノマス免疫系が何を「自己」と「非自己」の境にしているかはよく分かっていません。
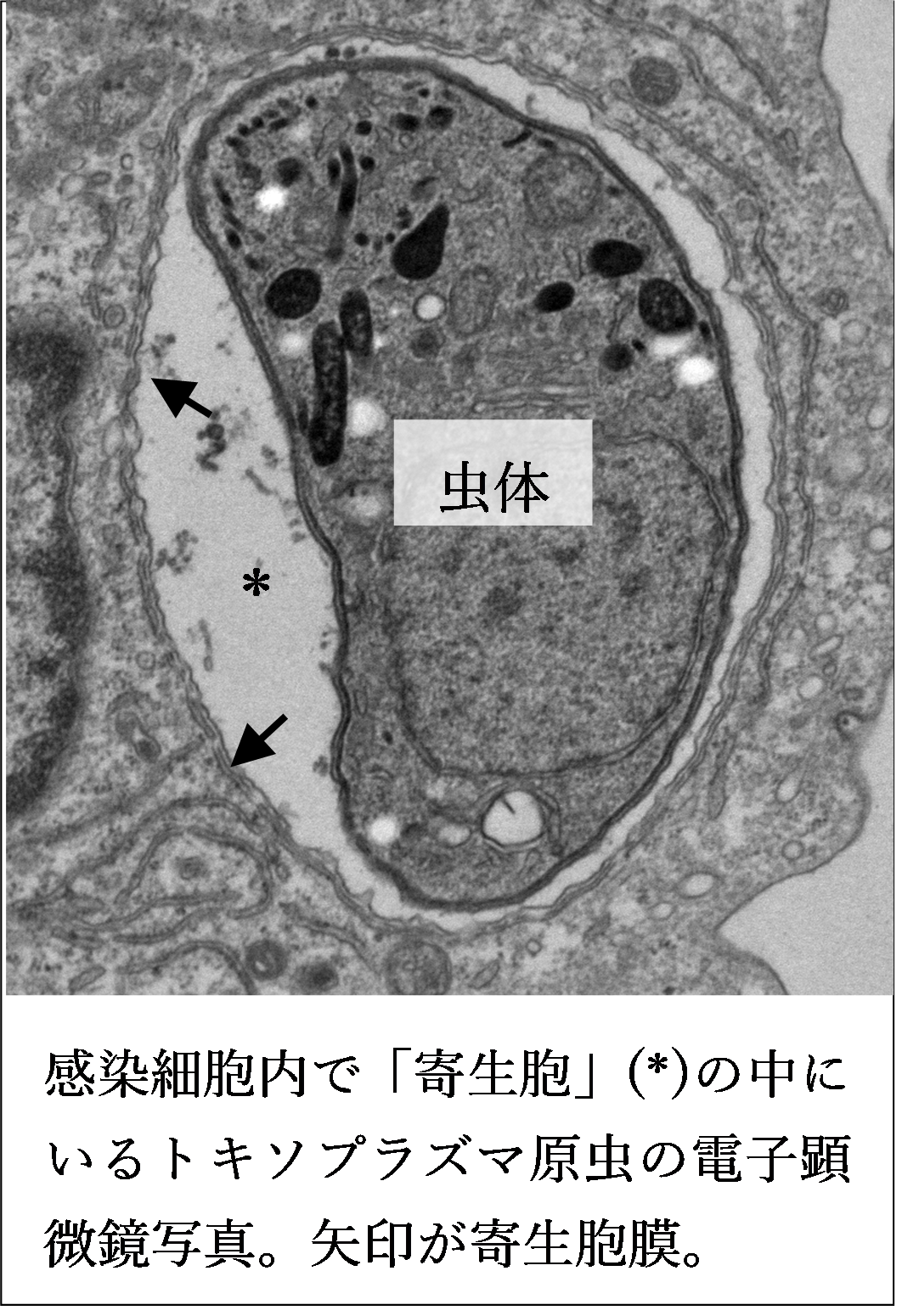 その理由として、細胞内に侵入した病原体の多くは剥き出しの生身の状態で細胞質に存在せず、宿主の細胞膜や小胞体・ゴルジ体などの膜オルガネラに由来する『病原体含有膜(Pathogen Containing Vacuole = PCV)』に包まれて存在していることが挙げられます。そして、セルオートノマス免疫系においてはインターフェロン(IFN)誘導性GTPaseなどが『膜』によって包まれた寄生虫・細菌・ある種のウイルスの病原体含有膜を破壊して、病原体を殺傷します。つまり、セルオートノマス免疫系は『元々自身由来の膜だった』構造体を攻撃していることになります。
その理由として、細胞内に侵入した病原体の多くは剥き出しの生身の状態で細胞質に存在せず、宿主の細胞膜や小胞体・ゴルジ体などの膜オルガネラに由来する『病原体含有膜(Pathogen Containing Vacuole = PCV)』に包まれて存在していることが挙げられます。そして、セルオートノマス免疫系においてはインターフェロン(IFN)誘導性GTPaseなどが『膜』によって包まれた寄生虫・細菌・ある種のウイルスの病原体含有膜を破壊して、病原体を殺傷します。つまり、セルオートノマス免疫系は『元々自身由来の膜だった』構造体を攻撃していることになります。
また、セルオートノマス免疫系では寄生虫(真核生物)・細菌(原核生物)・ウイルスの細胞内感染を防御します。しかしながら、このような広範囲の生物種で保存されている物質は考えにくく、セルオートノマス免疫系が「非自己」として認識しているものは病原体由来の「PAMP」と異なり元々自己に由来する病原体のライフサイクルによって生じる分子パターンであると考えられてきましたが、その実態はわかっていませんでした。
最近、山本らは先行研究の中でインターフェロン誘導性GTPaseが、細胞内寄生性原虫であるトキソプラズマの病原体含有膜にある特定のリン脂質(PI5P)を認識していることを見出しました(Lee et al. Life Sci. Alliance, 2020)。PI5Pは通常宿主細胞膜ではPI(4,5)P2などに代謝され濃度が極めて低く保たれていますが、トキソプラズマ感染によって病原体含有膜上でなぜか生じた(生じてしまった)高い濃度のPI5Pの存在を、異常状態、すなわち、「非自己」として認識したと考えられます。
このようなトキソプラズマが宿主細胞膜に接地し宿主細胞膜上の様々なタンパク質を除いて病原体含有膜を宿主細胞膜から生じるという『病原体のライフサイクル』によって、独特の「非自己」パターンが生じたと思われましたので、我々はその「非自己」パターンをPLAMP(Pathogen “Life cycle”-Associated Molecular Pattern 和名「プランプ」)と名付けました。トキソプラズマのみならず広範な病原性微生物の宿主細胞内でのライフサイクルの各イベントを微生物学的に詳細に解析することによって、セルオートノマス免疫系が「非自己」として識別するPLAMPを見つけ、生体の自己・非自己認識に新たな概念を創り出すことを本研究の目的とします。
微生物学的研究をやっていますと、病原体は必ず免疫系に認識される「非自己」を隠すために様々な病原性因子を持ち、自身の生存にとって都合の良い環境を細胞内に作り出している場面に遭遇することがよくありますが、病原性微生物が自身の生存のために細胞内に作り出す分子パターンも広義の『PLAMP』と位置付け、病原性微生物のライフサイクルにおける病原性因子と宿主因子の関係に着目し、様々な病原体が織りなす新たなPLAMPの発見を通じて、セルオートノマス免疫系が識別する「細胞内膜の自己・非自己」の原理の解明を目指します。